Implante auditivo de tronco cerebral
La
Neurofibromatosis tipo 2 (NF-2) fue inicialmente descripta
por Wishart en 1822 y es genéticamente diferente de
la neurofibromatosis tipo 1 (NF-1), La NF-1 está asociada
con fibromas del sistema nervioso periférico mientras
que la NF-2 se caracteriza por la presencia de tumores del
sistema nervioso central.
La NF-2 es un desorden genético, autosómico
dominante con un 50% de riesgo de transmisión y tiene
una incidencia de 1 en 40.000 individuos.
En sus dos formas clínicas: Gardner o Wishart, esta
enfermedad está caracterizada por la presencia de numerosos
tumores del sistema nervioso central (de cráneo y espinales)
Los pacientes con NF-2, en general sufren de una pérdida
total de la audición debido al crecimiento o la extracción
quirúrgica de los neurinomas acústicos bilaterales.
Actualmente es posible restaurar una audición útil
a estos pacientes mediante la utilización de un Implante
Auditivo de Tronco Cerebral (IATC), que directamente estimula
los núcleos cocleares.
Por definición el IATC es un dispositivo que puede
proveer sensaciones auditivas a pacientes con sordera por
schwannomas vestibulares bilaterales.
El primer IATC fue desarrollado en el House Ear Institute
y fue realizado in 1979 por los Dres William House y William
Hitselberger. En ese momento el dispositivo utilizado fue
una prótesis monocanal con un electrodo bolita y un
sistema de transmisión percutáneo basado en
el sistema 3M-House de implantes cocleares.
El paciente tenía sordera bilateral, secundaria a la
extracción de tumores bilaterales del nervio auditivo
debido a NF-2. Esta tentativa fue temporariamente exitosa
pero el electrodo fue inestable y las sensaciones auditivas
del paciente comenzaron a disminuir hasta desaparecer.
Luego de esta primer experiencia, en 1986, los investigadores
del Instituto House desarrollaron un dispositivo más
adecuado para ser colocado en el receso lateral, que consistía
en dos electrodos de platino montados en una pieza de dacron
rectangular, diseñada para promover la integración
fibrosa. Veinticinco pacientes fueron implantados con este
sistema de 2 electrodos y luego con otro similar de 3 electrodos.
(Brackmann et al., 1993). Estas partes internas se conectaban
al procesador 3M-House.
En 1989 se comenzó a desarrollar una nueva generación
de IATC, los implantes multicanales, basados en el sistema
Nucleus 22 de Cochlear, esto ocurrió por un trabajo
en colaboración entre el House Ear Institute, Cochlear
Corporation y Huntington Medical Research Institute. (4)
En 1992. fue implantado el primer paciente con este dispositivo.
Esta prótesis multicanal ha sido desarrollada, basándose
en el implante coclear Nucleus 22. La placa de ocho electrodos
se coloca sobre la superficie de los núcleos cocleares,
en el receso lateral del cuarto ventrículo en el momento
de la extracción translaberíntica del tumor.
La estimulación se realiza a través de un sistema
transcutáneo, pudiendo utilizarse una variedad de estrategias
de comunicación y modos de estimulación, dependiendo
de las respuestas individuales frente a la estimulación
eléctrica. En un número importante de casos,
ha sido posible utilizar múltiples electrodos en los
mapas de calibración, sin efectos colaterales importantes.
En general, la utilización de electrodos múltiples
ha resultado en mejores percepciones
auditivas en pacientes implantados con un IATC multicanal.
La estimulación de los núcleos cocleares ha
producido sensación auditiva en aproximadamente el
82.2% de los casos, según un reciente estudio multicéntrico
en los Estados Unidos y los resultados observados fueron variables.
La FDA de los Estados Unidos aprobó el ITC para su
uso clínico en octubre del año 2000.
Implante
de Tronco Cerebral de 21 electrodos
Este dispositivo es un híbrido del implante Nucleus
24 cuyo procesador del habla, micrófono, bobina transmisora
externa y cables utiliza. Consta de 21 discos de platino de
0.7 mm de diámetro, colocados en tres filas paralelas
en un rectángulo de dacron.
Los 21 electrodos corresponden al electrodo número
2 al 22, en el software de programación.
En el centro de la bobina receptora interna existe un imán
removible. Tiene dos electrodos fuera del conjunto, con posibilidades
de ser tierra o referencia, posibilitando modos diferentes
de estimulación monopolar.
Es usado el procesador del habla Sprint del implante Nucleus
24 con la posibilidad de contener hasta 4 programas diferentes,
controles de volumen y sensibilidad y el uso de la estrategia
Speak y otras estrategias. Es posible también realizar
Respuestas Telemétricas Neurales.
Criterios
de Selección
Debido a la naturaleza de los tumores producidos por la NF2
y la eliminación de audición residual por el
abordaje quirúrgico translaberíntico, no se
establece criterio audiológico específico.
Los criterios de selección actuales son los siguientes:
* Diagnóstico de NF2.
* 12 años de edad o mayor (post-lingual)
* Necesidad de remoción tumoral (1ro ó 2do lado)
o como un procedimiento separado.
* Adecuado desde el punto de vista médico y psicológico.
* Expectativas reales.
*Pacientes aceptando participar en sesiones de programación
regulares, en evaluaciones y seguimiento.
Debido a que la sordera bilateral típica es inevitable
en estos pacientes, la implantación durante la extracción
del primer tumor del ángulo pontocerebeloso es permitido
en general en pacientes más jóvenes para proveer
una segunda oportunidad para colocación del implante
si la primera no resultara óptima.
La implantación en el primer lado también permite
a los pacientes ajustarse a la información eléctrica
a medida que la audición empeora en el otro oído.
Generalmente el uso del dispositivo es limitado en estos casos,
según un estudio reciente de 163 pacientes implantados
en 15 centros; el 71 % de los pacientes implantados en el
primer lado no usaba el ITC comparado con un 36% de los implantados
en el segundo lado.
Contraindicación
Debido al posible daño de los núcleos cocleares
como resultado de un tratamiento radioterápico, los
pacientes que hayan sido sometidos a gamma knife deberían
ser considerados con extremo cuidado. El uso de la radioterapia
estereotáxica previa fue señalada como una contraindicación
pero en la actualidad no es considerada así en todos
los casos.
Consideraciones
anatómicas
Los pacientes son sometidos a una otoneurocirugía.
El blanco del electrodo es el complejo nuclear coclear dorsal
y ventral. En el hombre, el pedúnculo cerebeloso forma
la base del tronco que cubre dicho núcleo auditivo.
Este hecho hace que el núcleo no sea visible directamente
al cirujano y deba ser localizado a través de ciertas
líneas de demarcación. (6) Fig. 1. (muestra
las mayores estructuras de la unión pontomedular a
través de un abordaje Translaberíntico).
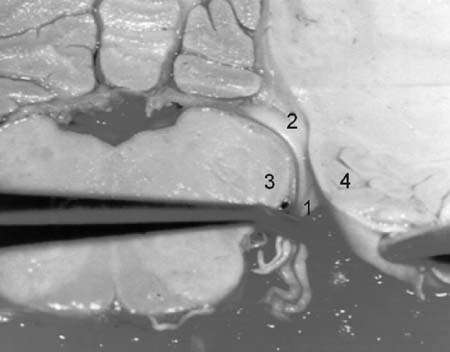
Fig 1:
1- Foramen de Luschka.
2- Receso lateral.
3- Flóculo.
4- Núcleos auditivos.
5- Flóculos cerebelosos.
Justo inferior al foramen de Luschka se encuentra el origen
del IX par glosofaríngeo. Superior a este foramen se
encuentran la entrada y salida a los orígenes de los
nervios vestíbulococleares y del nervio facial. Esta
área puede ser frecuentemente distorsionada por el
tumor, aunque la asistencia computada de la reconstrucción
tridimensional del área del núcleo coclear en
un paciente con estos tumores del acústico muestre
la ubicación del complejo y los cambios por desplazamiento
que pueda haber sufrido dicha región.
El núcleo coclear viene encerrado en la superficie
del tronco cerebral dentro del receso lateral. Por ello para
realizar una adecuada estimulación con los electrodos
se debe colocar éstos completamente dentro del receso
lateral del lado estimulado y conservar esta posición
con alguna parte del electrodo adyacente al núcleo
coclear dorsal.
La desventaja de la falta de exposición es parcialmente
compensada por la estabilidad posicional proveída al
electrodo por el limitado espacio en el receso lateral.
Consideraciones
quirúrgicas
El abordaje quirúrgico para remover los tumores en
casos de implante de tronco es la craneotomía por vía
translaberíntica o sub-occipital. Esta ruta ha sido
creada para proveer el acceso más directo al receso
lateral y a la superficie oculta del núcleo coclear.
Hasta llegar a la ubicación correcta del equipo el
procedimiento quirúrgico es igual al de cualquier otro
abordaje por vía TL a excepción del corte del
pelo que debe ir un poco más posterior para hacer la
marcación correcta del área donde quedará
el receptor interno sobre el cráneo.
La incisión es en C retroauricular amplia por lo dicho
anteriormente y en un solo plano hasta el periostio óseo
Fig. 2.
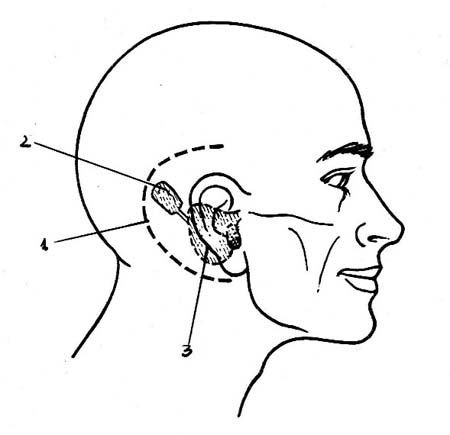
Fig. 2: Localización y tipo de incisión relacionada a la ubicación del implante.
1-
Incisión retroauricular en C.
2- Receptáculo para el dispositivo.
3- Mastoidectomía.
Se
hace una mastoidectomía cerrada con eliminación
de todas las celdas mastoideas.
Se expone el seno lateral sigmoideo, la dura de la fosa posterior
a él y la de la fosa media. Esto permitirá que
al retirar todo el hueso que recubre dichas estructuras se
pueda realizar la adecuada depresión por el cirujano
que utiliza un retractor o cánula mientras fresa ampliando
bien el campo quirúrgico y accediendo con buena visibilidad
a regiones más mediales. Así se evita entrar
en lo que podemos llamar un embudo.
Hecho el fresado mastoideo se comienza la laberintectomía.
Expuesto el conducto semicircular externo se esqueletiza el
block laberíntico previa exposición de la 2da
y 3ra porción del VII par, desde el segundo codo hasta
el forámen estilomastoideo. Para llegar al conducto
auditivo interno, el nerviducto del facial debe
ser expuesto en su cara lateral y posterior en toda la longitud
de la 3ra porción.
El punto inferior de este fresado es el bulbo de la Yugular.(2)
(3)
Se eliminan los canales semicirculares dejando como punto
de reparo el extremo anterior de la ampolla de CSSuperior
ya que más adelante se encuentra la porción
laberíntica del VII par.(2) (3)
El exponer la cara interna del vestíbulo permite calcular
que sus límites superior e inferior delimitan el borde
superior e inferior del conducto auditivo interno y su orientación
es posterior y medial como si fuesen del vestíbulo
al ángulo sinodural.
Fresando en esta dirección exponemos la dura del CAI
vista por transparencia como una zona azul; ésta se
ensanchará hacia medial hasta llegar al poro acústico,
límite más medial del CAI.
El límite posterior es la dura de la fosa posterior,
y entre ambas duramadres hay un puente o medialuna ósea;
borde posterior del poro acústico.
El hueso superior al CAI, el labio superior y el inferior
el labio inferior.
Se deben fresar hasta alcanzar la pared anterior del CAI.
Antes de abrir la dura es prudente localizar la porción
laberíntica del VII par y para abrir la dura del CAI
se hace una incisión longitudinal al mismo y otra transversal
en T en el extremo más lateral.
Así accedemos al tumor el cual una vez resecado permite
llegar al tronco e identificar las neuroestructuras que se
utilizan como referencia para la adecuada colocación
de los electrodos. El monitoreo neurofisiológico (7)
es fundamental; ya que al colocar los electrodos se harán
respuestas eléctricas evocadas cerebrales y se monitorean
además los nervios craneales V par (motor), VII par
y IX.
Solo con el registro de los picos 3 – 4 y 5 del BERA
electrico se tendrà la certeza de la correcta posicion
de los electrodos encontacto con los nucleos auditivos.
En el área cortical ósea posterior a la vía
de abordaje TL se hace el tallado de un receptáculo
circular para el receptor interno que irá sobre dicha
cortical ósea.
Este círculo se comunica con la vía de abordaje
por medio de un canal fresado en la corteza craneal hacia
delante y que permite el paso del electrodo hacia el interior
del cráneo. Fig 3a.(2) (3)
Se tallan agujeros, dos superiores y dos inferiores, intercomunicados,
al círculo que servirán para pasar el hilo de
fijación del receptor interno. Fig. 3b.
Luego de una hemostasia exaustiva con bipolar se coloca el
equipo original fijándolo con monocryl para evitar
desplazamientos; los electrodos son llevados hacia el interior
de la craneotomía TL al ángulo pontocerebeloso.
Normalmente el plexo coroideo marca la entrada al receso lateral,
foramen de Luschka, y el solitario y oblícuo techo
del receso lateral señala la superficie del Núcleo
Coclear Ventral. Esta estructura puede no estar claramente
visible sobretodo si un gran tumor distorsionó el aspecto
lateral del tronco y la médula. Pero siguiendo el recorrido
del VIII par visualmente llegamos a la apertura del receso
lateral en estos casos. El VII y IX par también pueden
ser usados como referencia para llegar adecuadamente a dicho
receso.
La ubicación del foramen de Luschka se logra a través
de la salida de LCR por una maniobra anestesiológica
de Valsalva intraoperatoria. (2) (3)
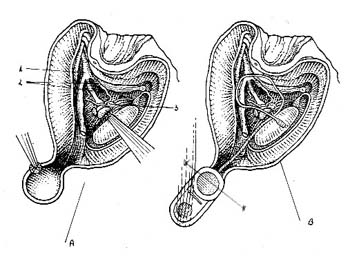
Fig. 3:
A- fresado de receptáculo externo y su relación
a la vía de abordaje.
1- ACI.
2- VII par.
3- Plexos coroideos.
B- ubicación final del equipo externo previo a la colocación del electrodo.
Luego
de localizar la apertura del foramen de Luschka el electrodo
es colocado en posición con finos fórceps y
el transportador de los electrodos es pasado cuidadosamente
dentro del receso lateral con los electrodos mirando hacia
superior.
Colocados los electrodos son estimulados para confirmar su
posición correcta, esto lo realiza un neurofisiólogo
intraoperatoriamente, siendo muy importante observar que dicha
estimulación no genere estímulos en otros pares
craneales ni afecte funciones vitales del tronco monitoreadas
intraoperatoriamente.(2) (5) (7)
La fijación en la posición definitiva para el
electrodo se hace con un pequeño trozo de grasa o musculo,
y el electrodo de referencia lo colocamos debajo de la fascia
del músculo temporal.
Se cierra la vía de abordaje aproximando la duramadre
abierta con puntos y colocando grasa abdominal en la cavidad
como relleno tal como se usa en los abordajes translaberinticos,
además se bloquea la trompa de Eustaquio para evitar
la salida de LCR por la misma. Fig. 4a y b.
Se cierra la herida por planos, se coloca un vendaje compresivo
y el cateter lumbar.
(2) (4)
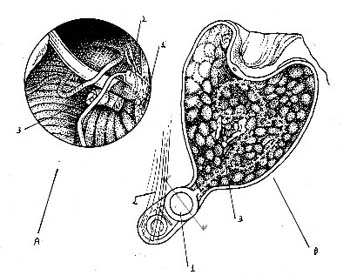
Fig. 4:
A- Ubicación final del electrodo en el receso lateral dentro del foramen de Luschka.
1-
Plexos coroideos.
2- IATC colocado en el receso lateral.
3- VIII par seccionado.
B- Esquema definitivo con la fijación del receptor externo y relleno con grasa abdominal de la vía de abordaje.
1-
Implante.
2- Músculo temporal.
3- Electrodo.
4- Grasa abdominal rellenando la cavidad.
Post
operatorio
El paciente queda en UTI por 24 a 48hs dependiendo este tiempo
de sus funciones vitales y de la funcionalidad de sus pares
mixtos.
Colocado el catéter lumbar (intraoperatoriamente) para
drenado de LCR por 72hs, el mismo permite la disminución
de la presión del líquido evitando aún
más la posibilidad de fístulas. Habitualmente
dejamos que drene 50 a 80cc cada 8hs.
La posición debe ser a 30° y el vendaje permanecer
compresivo por 4 días.
Los antibióticos se dan intraoperatoriamente y por
6 a 7 días postoperatoriamente.
Complicaciones
Como inmediata podemos mencionar la fístula de LCR
por herida o por trompa de Eustaquio, esta ultima se manifiesta
por perdida nasal de LCR. Por lo general las fístulas
se resuelven con vendaje compresivo, la adecuada elevación
de la cabeza y el drenaje lumbar de 80cc cada 8hs.
La meningitis es sobre agregada generalmente a la fístula
pero cede con los ATB habituales y con el tratamiento de la
fístula que en un 99% de los casos es médico.
Infecciones menores pueden ocurrir en la piel de la cabeza
por la presión generada por el imán sobre el
receptor interno, pero las mismas se solucionan con antibióticos
tópicos.
Caso clínico
FRC, primer paciente en recibir un IATC en Latinoamerica,
fue implantado por nosotros a los 19 años, con una
pérdida auditiva progresiva, bilateral, profunda, neural.
La RMN demostró la presencia de neurofibromas acústicos
bilaterales y también otros tumores en otros nervios.
Su pérdida auditiva comenzó en el oído
izquierdo, el diagnóstico de NF2 se realizó
en 1993. La cirugía del primer neurinoma fue en 1996,
cuando tenía18 años, durante esta cirugía
se realizó también la extracción de tumores
en la columna vertebral. El joven tenía una pérdida
auditiva profunda, bilateral, neural en ese momento y también
problemas vestibulares, con graves alteraciones del equilibrio
y problemas visuales.
El 21 de mayo de 1997 se realizó la cirugía
del neurinoma del oído derecho y se implantó
el IATC. En julio de 1997 se realizó la cirugía
para extracción de tumores en la columna.
El 4 de agosto de 1997 se realizó el encendido del
IATC, calibrándose los distintos electrodos de su implante
e incorporando en el mapa del procesador, aquellos electrodos
que reunían las condiciones para ser utilizados.
La estimulación auditiva inicial y programación
del procesador del habla se realiza generalmente después
de 6 semanas de la cirugía, en este caso en particular,
debido a las condiciones del paciente ocurrió después
de 10 semanas de realizada la cirugía.
Durante la programación del implante, se instruyó
al paciente respecto a la posibilidad de aparición
de sensaciones no-auditivas. Estas sensaciones pueden aparecer
por la estimulación de algunos electrodos, por ejemplo,
hormigueo en la cabeza o en el cuerpo, vértigo, inestabilidad,
estimulación facial, sensaciones vibratorias en el
ojo, movimientos en la mano y brazo generalmente en forma
homolateral al implante. Es importante evaluar la magnitud
de esos efectos colaterales en una escala de 1 a 4, donde
1 = apenas percibido, 2 = presente en forma consistente, pero
tolerable, 3 = desagradable y 4 = intolerable. No fueron observados,
en este paciente, efectos no-auditivos en la programación
del implante que imposibilitara la activación de todos
los electrodos. Cuando aparecen esas sensaciones como efecto
colateral es posible reducirlas o eliminarlas alterando la
duración de los pulsos (por ejemplo puede ocurrir que
esas sensaciones no auditivas aparezcan con un ancho de pulsos
de 100useg y desaparezcan al aumentar ese ancho de pulsos
a 200useg), cambiando el apareamiento de electrodos ( seleccionar
un electrodo tierra diferente puede ser de utilidad) o eliminando
esos electrodos del mapa de programación. Es común
que esos efectos colaterales puedan disminuir o hasta desaparecer
con el uso del implante, en cuyo caso esos electrodos pueden
reincorporarse al mapa del procesador.
Una variedad de modos de estimulación pueden emplearse
en la programación, modo monopolar, bipolar y una combinación
“variable” de ambos. En forma similar una variedad
de estrategias de codificación es accesible.
La estrategia de codificación Speak fue usada en este
paciente con la utilización de electrodos dobles y
se probaron todos los modos y sus combinaciones, eligiéndose
en ese momento una combinatoria de modos monopolar y bipolar.
Posteriormente se cambió el modo de estimulación,
continuando la utilización de la estrategia Speak.
Durante la programación se realiza la medición
de los umbrales mínimos y máximos confortables
en los distintos electrodos elegidos y de aparecer sensaciones
no auditivas, las clasificamos en cuanto a la severidad para
determinar la posibilidad de la inclusión de ese electrodo
en el mapa de programación. Un número importante
de técnicas de programación es accesible en
el software de IATC para ayudar al audiólogo a reducir
la aparición de efectos colaterales. Aunque la aparición
de estimulación facial, como efecto colateral, es posible
pero poco frecuente en los implantados cocleares, la aparición
de efectos no auditivos es frecuente en los implantados de
tronco cerebral por la gran proximidad de núcleos y
nervios motores y sensitivos dentro del tronco cerebral.
Debido a que el control de muchas actividades autónomas
críticas está localizado en el tronco cerebral,
los signos vitales son de rutina monitoreados durante la programación
inicial con el IATC.
Luego de realizada la medición de los electrodos, una
parte crucial es el ordenamiento de los mismos, de acuerdo
a la percepción de altura tonal que ellos producen.(8)
A diferencia de la simple organización tonotópica
coclear, los núcleos cocleares presentan una muy compleja
organización tonotópica. Debido a la complejidad
de esa organización y a las variaciones en situación
de los electrodos de paciente a paciente, una detallada exploración
de la altura tonal de cada electrodo es importante en la programación.
Algunos pacientes demuestran un aumento o disminución
en la percepción de altura tonal cuando se estimulan
los electrodos de laterales a mediales. Este paciente pudo
realizar la clasificación por altura tonal de los diferentes
electrodos, de esa manera se ordenaron y se adjudicaron las
frecuencias. Se instruyó al paciente para clasificar
cada electrodo en una escala de 1 a 100, donde 1 corresponde
a tono grave y 100 muy agudo. También se realizó
con el software de programación la comparación
de la altura tonal entre 2 pares de electrodos por vez, a
los efectos del ordenamiento por altura tonal.,
Con las modalidades de programación elegidas el joven
recibió desde un primer momento sensaciones auditivas
útiles, fue capaz de escuchar su voz, las voces de
los demás, también ruidos ambientales y sus
resultados se comparan favorablemente con los obtenidos en
media en estos pacientes con este tipo de dispositivo, en
un estudio multicéntrico realizado en los Estados Unidos
.Está utilizando en su mapa de programación
la estrategia Speak, con 6 máximas y una velocidad
de 1500 Hz, un ancho de pulsos de 400 sec, y la tabla frecuencial
que abarca desde 300Hz a 8.368Hz. El modo de estimulación
es Monopolar. Los rangos dinámicos en los diferentes
electrodos están entre 30 y 34 unidades.
Resultados
El joven utiliza el implante todas las horas en que está
despierto, desde el momento del encendido. Califica el IATC
como extremadamente útil para la comunicación
y percepción de voces y ruidos ambientales.
El uso del IATC ha mostrado que sensaciones auditivas beneficiosas
pueden lograrse.
Este paciente ha demostrado crecientes beneficios en su comunicación,
escucha su propia voz, diferencia voces masculinas de femeninas,
voces de adultos vs. voces de niños, tiene excelente
alerta auditivo al nombre (aún a distancia), distingue
el habla de ruidos medio ambientales y también diferencia
ruidos entre sí (teléfono, portero, ladrido
de perros, ambulancia).Consigue realizar diferenciaciones
entre palabras con múltiples diferencias espectrales,
en grupos cerrados.
El paciente nos señala que el implante es su “oído”,
que le resulta muy útil en sus interacciones sociales,
mejora la velocidad y calidad de su lectura labial. La visión
de este joven está muy disminuída.
A los cuatro años de uso del IATC, en modalidad auditiva
(A) o sea sin LL, en forma sólo visual (V) o en forma
auditivo visual (A+V), tiene los siguientes resultados en
pruebas de percepción del habla:
Identificación
de Vocales
A V A+V
50% 37% 76%
Identificación
de Consonantes
A V A+V
12% 35% 41%
Oraciones
A V A+V
0% 20% 58%
En
el test de Ling, sin lectura labial, a l m de distancia, voz
intensidad normal,
detecta los 6 fonemas del test : /a/, /u/, /i/, /sh/,/s/,/m/.
Horas
de uso diario del IATC
Usa el implante más de 8 horas diarias. (mientras está
despierto)
Conclusiones
El IATC debe considerarse en los pacientes con NF2 en especial
cuando se realiza la cirugía para la extracción
del neurinoma. Candidatos adecuados resultan todos los pacientes
con aquella patología y las condiciones detalladas
en los criterios de selección.
El grupo de IATC consiste de profesionales de muchas disciplinas:
otología, neuro-otología, neurocirugía,
audiología, electrofisiología, neurología,
también participan con frecuencia, psicólogos,
oftalmólogos, geneticistas.
El impacto de este tipo de implantes en la vida de esos pacientes
ha resultado muy positivo.
En una muestra de 92 pacientes que usan en los Estados Unidos
el IATC, los resultados fueron:
* 82.2% reciben sensación auditiva.
* 12% reconocen el habla en formato abierto sin lectura labial.
* 17.8% no tuvieron estimulación auditiva con el IATC.
Los resultados observados son interesantes y aumentan nuestro
conocimiento sobre las potencialidades del sistema auditivo
central frente al estímulo eléctrico y las posibilidades
de realización auditiva con la estimulación
eléctrica en la superficie de los núcleos cocleares
haciendo un by-pass de la cóclea y el nervio. (9) (10)
(11)
Desarrollos
Futuros
Un nuevo conjunto de electrodos llamados de penetración
en el tronco cerebral ha sido desarrollado. En estudios en
animales este diseño ha demostrado la posibilidad de
activar mayores grupos de neuronas auditivas. El dispositivo
está compuesto de 4 a 6 agujas de iridium (electrodos).
La longitud de los electrodos aguja es de 1 a 4 mm y tiene
dos electrodos estabilizadores. Este nuevo sistema de implante
realizado por un trabajo conjunto entre el House Ear Instute,
Huntington Medical Institute y Cochlear Corporation tiene
la posibilidad de ofrecer una realización auditiva
mejor debido a un mejor acceso a la compleja organización
tonotópica de los núcleos cocleares.
Resumen
Pacientes con NF-2 desarrollan schwannomas vestibulares bilaterales
y la remoción de los mismos frecuentemente causa lesión
del nervio auditivo y consecuentemente sordera. Los implantes
cocleares son una opción válida para el resto
de los pacientes, en aquellos escepcionales casos que preserven
el nervio auditivo luego de la cirugía.
Los demás, pueden favorecerse con un implante de tronco
cerebral colocado en el receso lateral del IV ventrículo
para estimular el complejo de núcleos cocleares.
El IATC es similar en diseño y funcionamiento al implante
coclear pero está dirigido a estimular los núcleos
cocleares en lugar de la cóclea. El IATC multicanal
ha proporcionado mejores resultados que la versión
previa de implante monocanal.
Summary
Patients
with NF-2 develop bilateral vestibular schwannomas whose removal
often
results in damage of the VIIII nerve resulting in deafness.
Cochlear implants
are not an option for these patients because they have no
auditory nerve for estimulation. For these patients the option
would be the auditory brainstem implant (ABI), to be placed
into the lateral recess
of the IV ventricule to stimulate the cochlear nucleus complex.
The ABI is similar in design and function to a cochlear implant,
but it is designed
to stimulate the cochlear nucleus rather than the cochlea.
The multichannel ABI has resulted in improved performance
in relation with the former
single channel system.
Bibliografía:
1- Brackmann DE, Hitselberger WE, Nelson RA, et al.: Auditory
Brainstem Implant:
I. Issues in Surgical Implantation. Otolaringology Head and
Neck Surgery 108:624-633,
1993.
2- Brackmann DE, Shelton C, Arriaga M, Otologic Surgery, Cap.
59, 1994.
3- Diamante VG, Sastre R. Hueso Temporal, Anatomía
Quirúrgica aplicada a la Microcirugía. 59-67,
1998. Fundación de ORL.
4- Hitselberger WE, House WF; Edgerton BS, Whitaker S. Cochlear
Nucleus Implant.
Otolaringology Head and Neck Surgery 92:52-54, 1984.
5- Luetje CM, Whittaker CK, Geier L, et al.: Feasibility of
multichannel human cochlear
nucleus stimulation. Laryngoscope 102(1): 23-25, 1992.
6- Monsell EM, McElveen JT, Hitselberger WE, House WF,:
Surgical approaches to the human cochlear nucleus complex.
Am J. Otol. 8(5): 450-455, 1987.
7- Niparko JK, Kileny PR, Kemink JL, et al.: Neurophysiologic
Intraoperative monitoring:
II. Facial nerve function. Am J Otol 10: 55-61, 1989.
8- Otto S.R., Ebinger K., Staller S.J. Cochlear Implants:
Clinical Trials with the Auditory Brain Stem Implant . In
Cochlear Implants,
ed. S. Waltzman and Cohen N. Cap. 17, 2000.
9- Otto, S.R., Brackmann D.E., Hitselberger W.E., Shannon
R.V.
The Multichannel Auditory Brainstem Implant Update: Performance
in 55 Patients.
Draft Feb., 2001
10- Otto, SR, Shannon, RV, Brackmann, DE, Hitselberger, W,
Staller, S, Menapace,
C. The multichannel auditory brainstem implant: Performance
in twenty patients.
Otolaryngol. Head and Neck Sur. 1998, 118:291-303.
11- Shannon R.V., Fayad J., Moore J., Lo W.M., Otto S., et
al.:
Auditory Brainstem Implant: II. Postsurgical issues and performance.
Otolaringology Head and Neck Surgery 108:634-642, 1993.